研究背景
程序性细胞死亡受体1(programmed cell death-1,PD1)是表达于多种免疫细胞上的重要免疫检查点,参与调节免疫稳态。PD1与其配体PD1配体1(PD1 ligand-1,PDL1)或PD1配体2(PDL2)结合后,诱导T细胞对抗原或癌细胞的免疫耗竭。目前,阻断PD1/PDL1相互作用在肿瘤治疗中取得了突破性进展,并具有显著的临床疗效持久性。
自身抗体(autoantibody,AAb)是一种针对自身抗原的抗体,在癌症患者中可以被大量检测到。AAb的产生在癌症早期检测、疾病预后、治疗反应或不良反应预测中具有重要意义。人自身抗体主要包括IgG、IgM和IgA,其中IgG对抗原具有高亲和力,参与细胞清除和信号转导诱导的致病过程。目前已有研究报道在癌症患者中血清抗PD1 IgG或抗PDL1 IgG的产生,但还没有研究系统地研究它们的IgG和亚型在广泛的癌症类型中的分布。此外,关于自身活性的抗PD1 AAb和抗PDL1 AAb与临床参数的关系以及它们在免疫治疗中的作用也知之甚少。
2022年7月,中国中医科学院肿瘤医院的石远凯教授、北京协和医院韩晓红教授及国家蛋白质科学中心·北京的于晓波教授在Cancer Immunology Immunotherapy(IF:6.63)期刊发表了“Anti-PD1/PDL1 IgG subclass distribution in ten cancer types and anti-PD1 IgG4 as biomarker for the long time survival in NSCLC with anti-PD1 therapy”研究论文,首次报告了10种癌症类型中预先存在的抗PD1/PDL1 AAb IgG和其亚型的分布。此外,抗PD1 AAb IgG4亚型被确认与总生存期(OS)相关,这可能是抗PD1治疗NSCLC患者生存获益的潜在生物标志物。

主要成果
● 确定了十种癌症(肺癌、乳腺癌、食道癌、结直肠癌、肝癌、前列腺癌、宫颈癌、卵巢癌、胃癌和淋巴瘤)中的循环抗PD1 AAb、抗PDL1 AAb及其亚型分布。
● 确定了预先存在的AAb与接受抗PD1治疗的非小细胞肺癌(non-small celllung,NSCLC)患者生存期之间的关系。
研究设计
【样本队列】:
共298名癌症患者的血浆样本:190名没有接受抗PD1治疗的患者(28名肺癌,18名乳腺癌18名食道癌,18名结直肠癌,18名肝癌,18名前列腺癌,18名宫颈癌,18名卵巢癌,18名胃癌和18名淋巴瘤),108名接受抗PD1治疗的NSCLC患者。
【研究路线与内容】:
通过酶联免疫吸附试验(ELISA)检测了190名癌症患者的血浆抗PD1/PDL1 AAb IgG和亚型(IgG1-4),涵盖10种癌症类型,分析了AAbs与多个临床参数的综合相关性。作者接着进一步在76个接受抗PD1治疗的非小细胞肺癌(NSCLC)样本中测试了这些AAbs,分析了AAbs水平与生存期的关系,并在一个独立的队列中得到验证(n=32)。
研究结果
在十种类型的癌症患者中全面检测抗PD1和抗PDL1 AAb IgG
该研究使用ELISA评估了共190名涉及10种癌症的患者的抗PD1 AAb IgG和抗PDL1 AAb IgG。实验内(r=0.98,图1A)和实验间(r=0.97,图1B)AAb检测信号存在显著相关性,批次内和批次间的平均CV分别为4%和7%,表明ELISA方法具有良好的重现性。
图1 ELISA检测自身抗体的重复性
在10种癌症患者的血浆中均可检测到抗PD1和抗PDL1 AAb IgG,非层次聚类分析表明IgG亚型聚类不同,说明这些AAb家族在癌症患者中具有不同的功能(图2A),而不同癌症类型的热图没有明显的分布差异(图3)。Anti-PD1 IgG在结直肠癌和食管癌中浓度较低,而在乳腺癌和卵巢癌中浓度较高(图2B),只有结直肠癌和卵巢癌之间的浓度有统计学意义(p =0.03)。与肝癌和乳腺癌相比,结直肠癌、宫颈癌和淋巴瘤中的抗PDL1 AAb IgG产生相对较低(图2B),而在多重比较中未达到统计学显著性。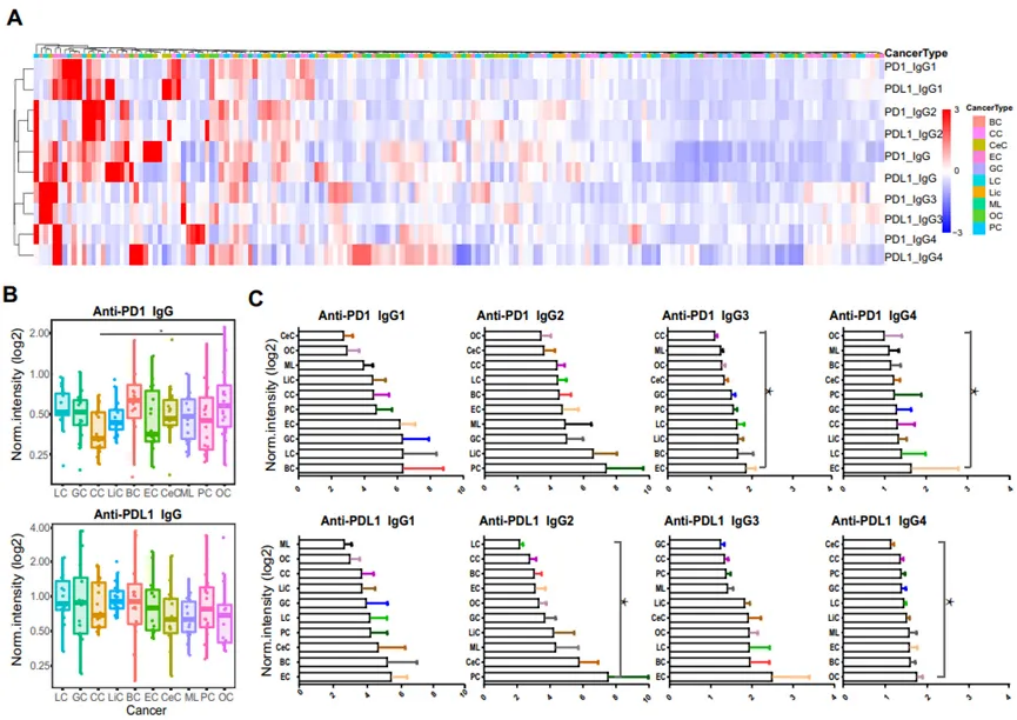
图2 十种癌症患者抗PD1和PDL1自身抗体IgG的全面检测
该研究进一步比较了不同癌症类型的抗PD1和抗PDL1 IgG的每个亚型,抗PD1和抗PDL1 AAb的IgG1分别在乳腺癌和食管癌中最高(图2C)。在IgG2亚型中,前列腺癌中的抗PDL1 IgG2值高于肺癌(p=0.024),抗PD1 IgG2在不同癌症类型中没有显著分布差异(图2C)。在IgG3亚型中,食管癌中的抗PD1 IgG3高于结直肠癌(p=0.041),而抗PDL1 IgG3在不同癌症类型中没有显著性(图2C)。食管癌中的抗PD1 IgG4高于卵巢癌(p=0.008),卵巢癌中的抗PDL1 IgG4高于宫颈癌(p=0.010)(图2C)。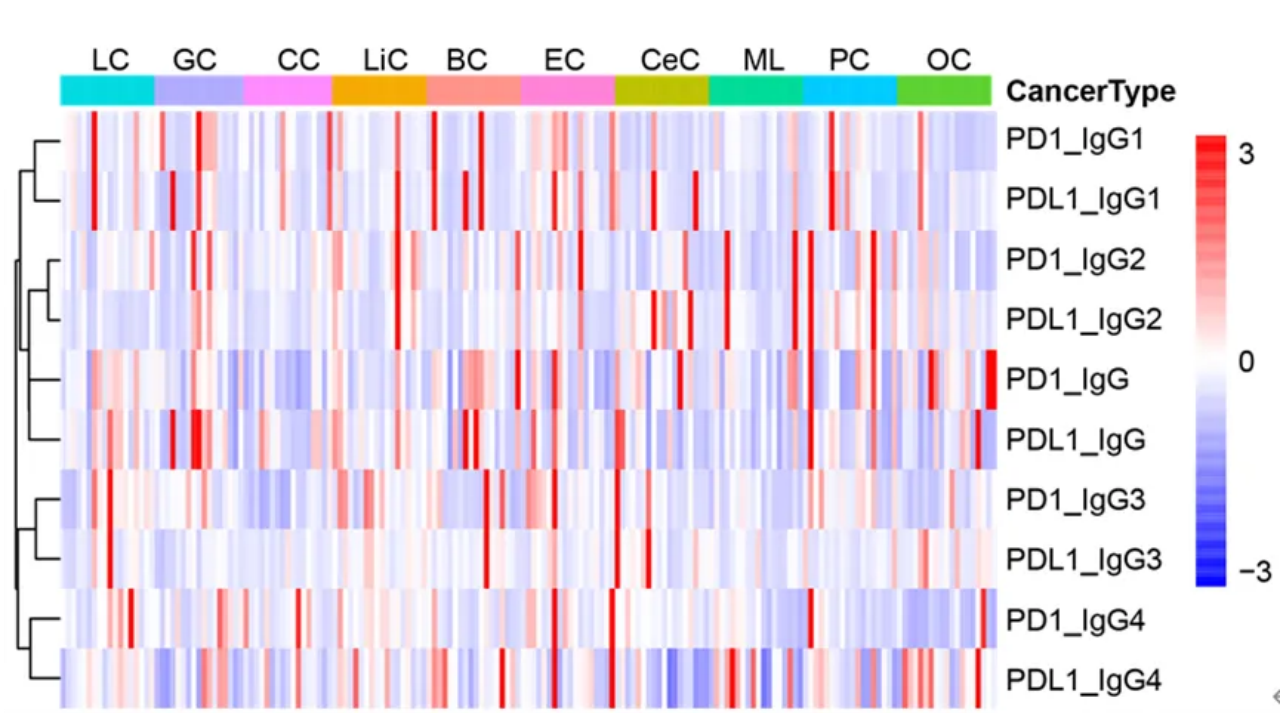
图3 180例癌症患者中抗PD1和抗PDL1 AAb相对表达模式的热图
十种癌症患者抗PD1/PDL1 IgG亚型分布
在结直肠癌、食管癌、肝癌、胃癌和卵巢癌中,抗PD1 IgG1、IgG2亚型的标准化水平显著高于IgG3和IgG4的值(p<0.05,图4A)。在肺癌和乳腺癌中,IgG1亚型高于IgG4,而IgG2和IgG3、IgG4亚型之间没有观察到显著性差异(图4A)。在宫颈癌和前列腺癌中,抗PD1 IgG2的平均OD显著高于IgG3和IgG4亚型;然而,IgG1未被显著高度检测到(图4A)。
对于抗PDL1 IgG亚型,该研究发现在结直肠癌中,IgG1和IgG2亚型显著高于IgG3和IgG4(p<0.05,图4B)。抗PDL1 IgG1被发现在其他两种癌症类型中大量产生,包括肺癌、食管癌(p<0.05,图4B)。在其余癌症类型中,IgG2水平最高(图4B)。该研究的结果表明IgG1和IgG2是抗PD1和抗PDL1 IgG的主要亚型。
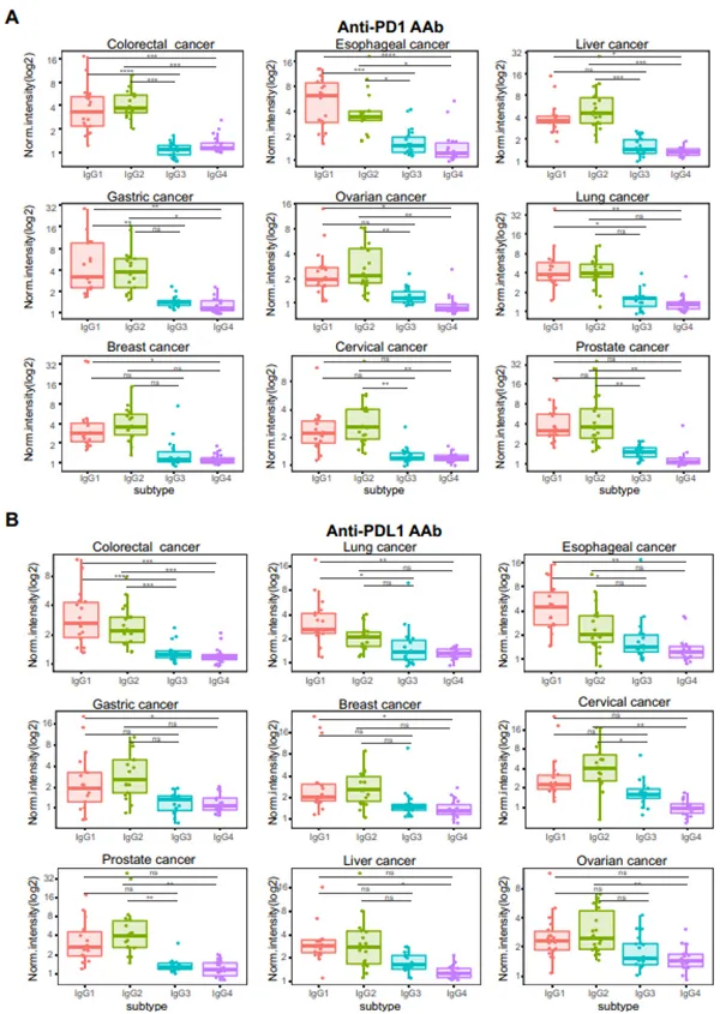
图4 抗PD1/PDL1 IgG亚型在九种癌症患者中的分布
抗PD1/PDL1 IgG亚型与临床数据的相关性分析
该研究对临床数据和实验室信息与AAb水平进行了全面的相关性分析,结果在各种癌症类型中显示出不同的模式(图5)。反映炎症增加的C反应蛋白(C-reactive protein,CRP)与肝功能变量聚集在一起,因此表明这些变量之间存在关联。腺苷脱氨酶(adenosine deaminase,ADA)是一种参与嘌呤代谢的酶,最早被发现参与免疫系统的发育和维持。在肺癌、结直肠癌和卵巢癌中发现ADA分别与抗PD1/PDL1 IgG3、IgG2、IgG1呈正相关。在肝癌中,HBV感染是一个危险因素,结果显示HBsAg与anti-PD1 IgG4和anti-PD1/PDL1 IgG3相关,在淋巴瘤中也发现HBV感染与anti-PD1 IgG3相关。另外,研究了临床数据与AAb亚型之间的其他相关性,例如,胃癌患者抗PD1/PDL1 IgG2抗体与MCV、MCHC,结直肠癌患者抗PD1/PDL1 IgG4抗体与血脂,食管癌患者抗PD1/PDL1 IgG4抗体与凝血功能的相关性。结果表明,在不同类型的肿瘤中,自身抗体与临床数据之间可能存在不同的相互作用。
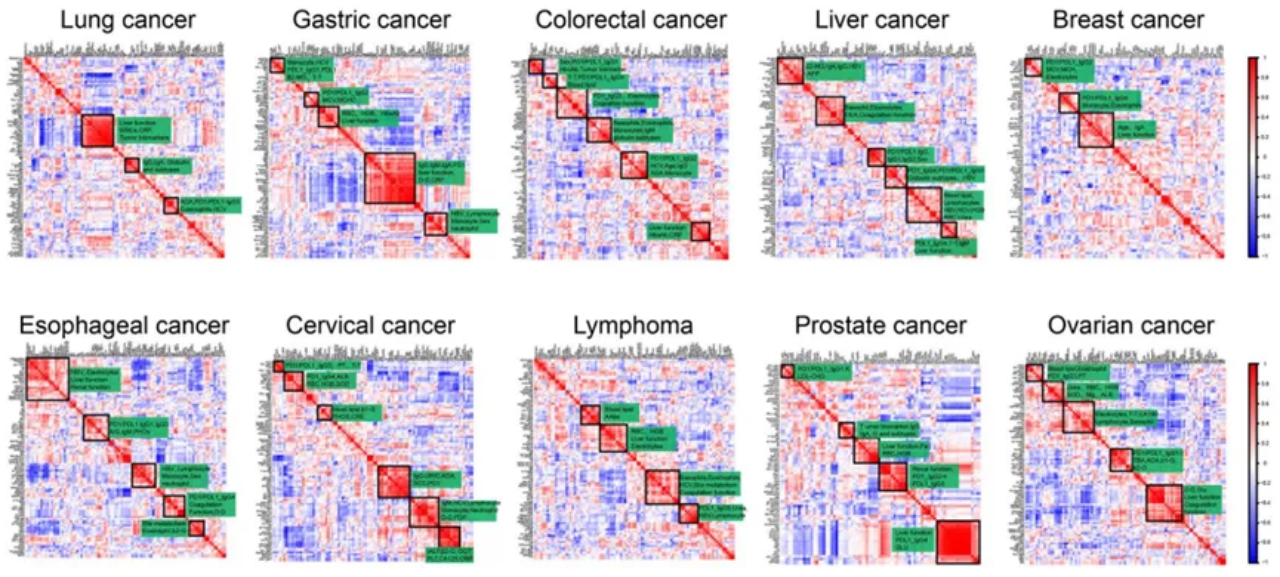
图5 十种癌症患者AAb与临床数据的相关性分析
不同癌症类型临床数据相关性的随机森林模型
各种癌症类型的不同分布模式表明,可以探索与癌症类型最相关的AAb和临床数据。该研究首先将这些癌症患者随机分配到训练队列(70%)和验证队列(30%)。使用随机森林模型在多个临床数据和AAb水平中选择特征来构建决策树(图6A),引导程序在不增加偏倚的情况下降低了模型的变异度,从而提高了模型的性能,最后以树中的多数投票进行分类。在肝癌、宫颈癌和淋巴瘤中,基于临床数据和AAbs的随机森林模型表现出最好的一致性,训练队列准确率分别为60%、60%和89%,验证队列准确率分别为83%、83%和50%(图6B)。与癌症类型最相关的前十个变量是年龄、HBsAg、PD1 IgG4、性别、MONO-数、SOD、PDL1 IgG4、NEUT数、HCY、PD1 IgG3(图6C),表明与这些参数与癌症的关系,但PD1/PDL1 IgG4和PD1 IgG3等AAb在癌症中的具体相互作用过程仍有待说明。
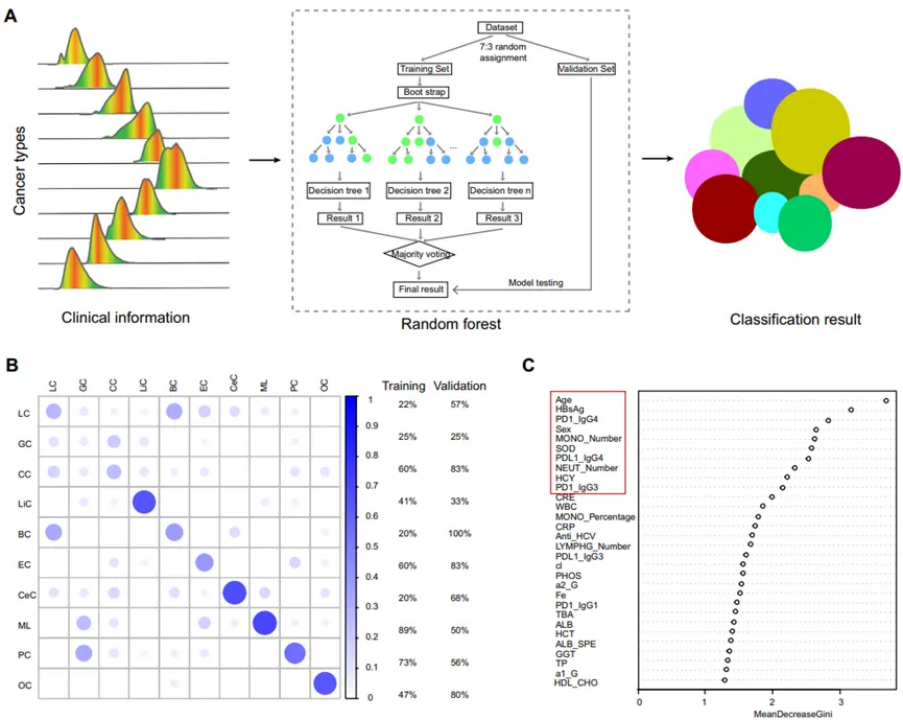
图6 使用随机森林的不同癌症类型的分类模型
抗PD1 IgG4在NSCLC抗PD1治疗中的预测价值
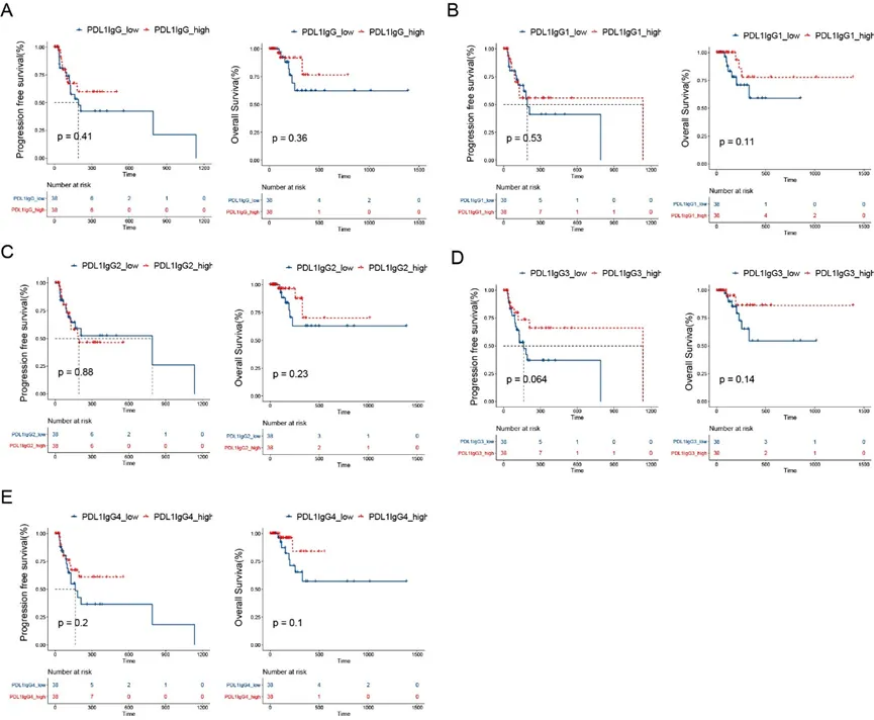
该研究的结果表明PD1/PDL1 IgG4和PD1 IgG3水平与癌症相关,但它们是否对抗PD1免疫疗法有影响仍未知。该研究检查了76名接受抗PD1治疗的NSCLC患者的AAb基线水平,分析了AAb水平与无进展生存期(progression-freesurvival,PFS)和总生存期(overallsurvival,OS)的相关性。Kaplan-Meier生存曲线表明,低抗PD1 IgG4水平在NSCLC患者中表现出良好的PFS,尽管没有统计学意义(图7A;p=0.088),但与OS相关(图7B;p=0.019)。抗PD1 IgG1、IgG2和IgG3与PFS或OS之间未观察到显著相关性(图7C-F)。抗PDL1 IgG和亚类显示与抗PD1治疗患者的生存无显著关联(图8)。
图7 发现队列(n=76)中抗PD1 IgG和亚型与生存的相关性
该研究在32名NSCLC患者的独立队列中进一步验证了这种关联,结果显示抗PD1 IgG4低的患者获得了更长的OS时间(p=0.031),但没有获得PFS(p=0.6)(图9)。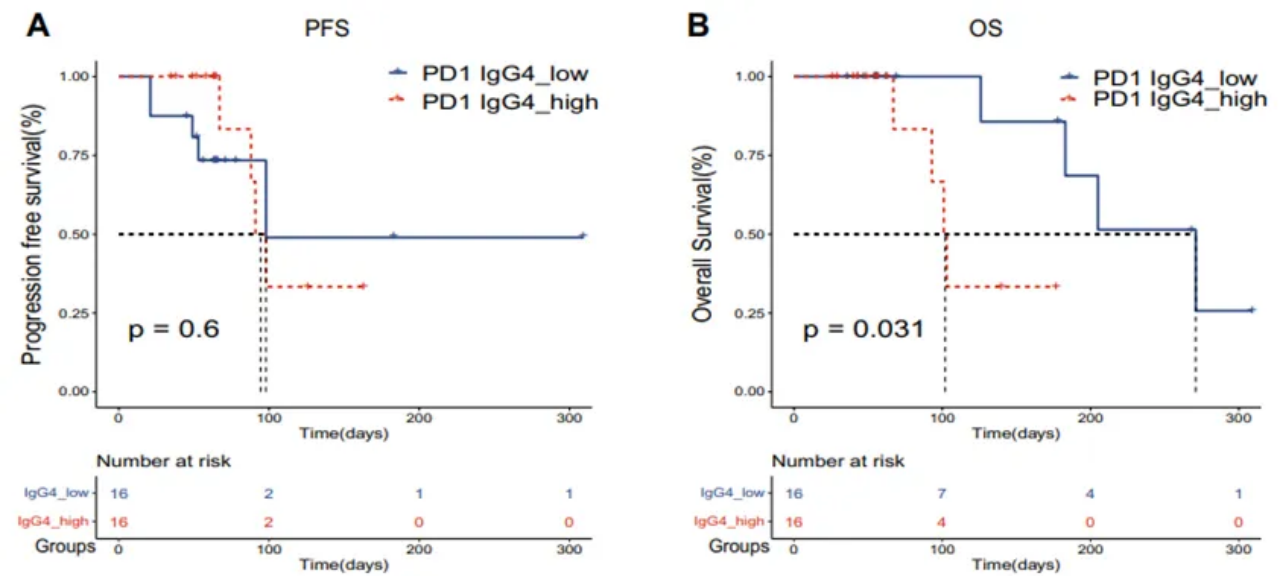
图9 抗PD1 IgG4与验证队列中存活率的相关性(n=32)
总结
该研究首次报告了抗PD1/PDL1 AAb及其亚型在多种癌症类型中的分布。此外,抗PD1 IgG4被鉴定并验证与抗PD1治疗的存活相关,它可能作为潜在的生物标志物来预测NSCLC中抗PD1治疗的存活并指导癌症患者的抗PD1治疗。
原文链接:https://doi.org/10.1007/s00262-021-03106-z
参考文献
Tan Q, Dai L, Wang Y, Liu S, Liang T, Luo R, Wang S, Lou N, Chen H, Zhou Y, Zhong Q, Yang J, Xing P, Hu X, Liu Y, Zhou S, Yao J, Wu D, Zhang Z, Tang L, Yu X, Han X, Shi Y. Anti-PD1/PDL1 IgG subclass distribution in ten cancer types and anti-PD1 IgG4 as biomarker for the long time survival in NSCLC with anti-PD1 therapy. Cancer Immunol Immunother. 2022 Jul;71(7):1681-1691. doi: 10.1007/s00262-021-03106-z. Epub 2021 Nov 24. PMID: 34817638.